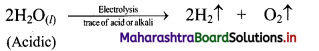
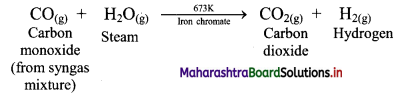
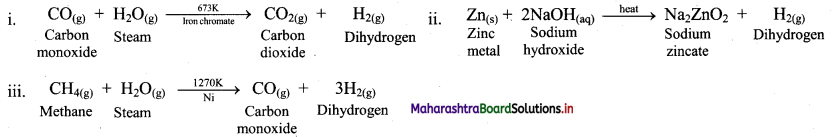
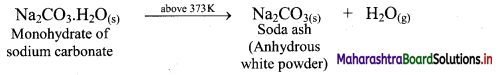
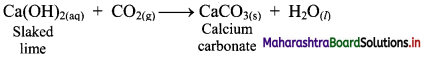
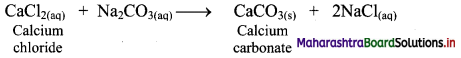
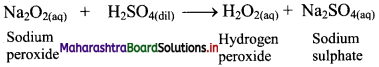
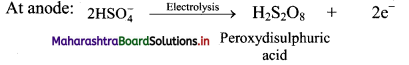
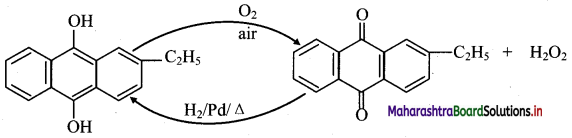
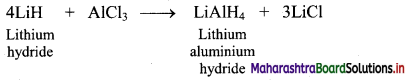
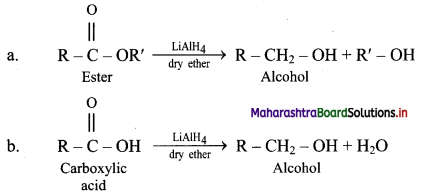
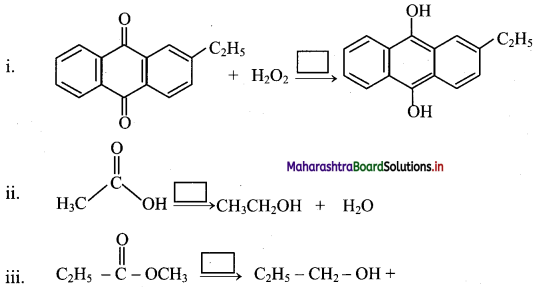
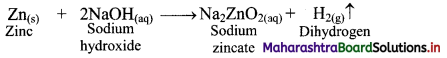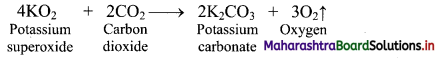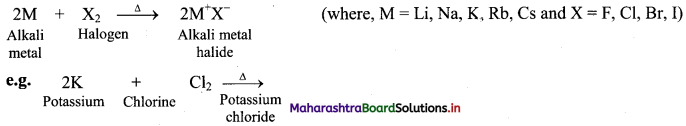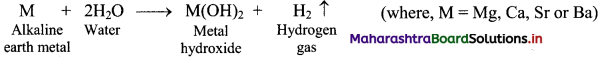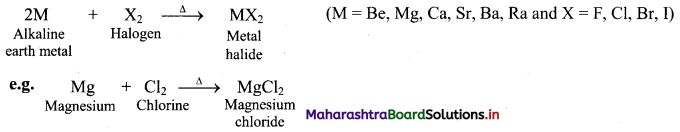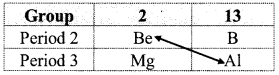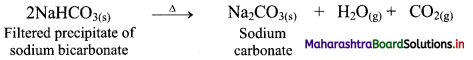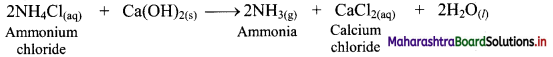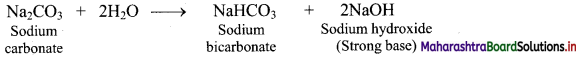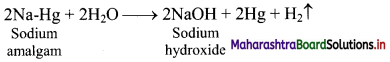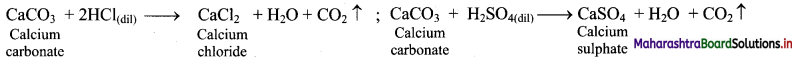Balbharti Maharashtra State Board 11th Chemistry Important Questions Chapter 9 Elements of Group 13, 14 and 15 Important Questions and Answers.
Maharashtra State Board 11th Chemistry Important Questions Chapter 9 Elements of Group 13, 14 and 15
Question 1.
What are p-block elements?
Answer:
- Elements in which the differentiating electron (the last filling electron) enters the outermost p orbital are p-block elements.
- Since maximum six electrons can be accommodated in p-subshell i.e., three p-orbitals, the p-block contains six groups numbered from 13 to 18 in the modem periodic table.
- The p-block elements show greater variation in the properties than s-block elements.
Question 2.
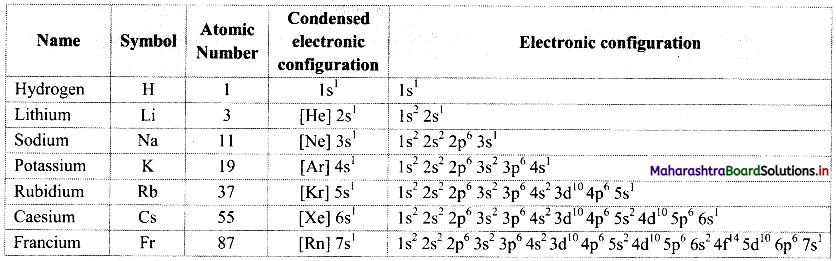
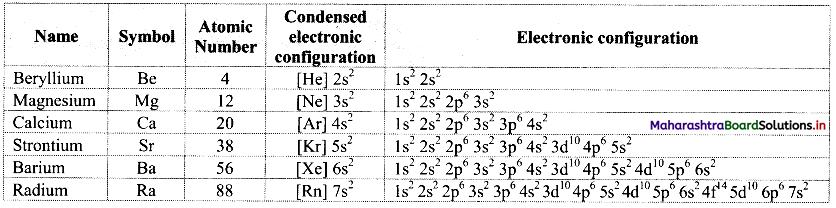
Write the names of the elements present in groups 13, 14 and 15.
Answer:
| Group | Name of family | Name of the elements |
| 13 | Boron family | Boron (5B), aluminium (13Al), gallium (31Ga), indium (49In), thallium (81Tl) |
| 14 | Carbon family | Carbon (6C), silicon (14Si), germanium (32Ge), tin (50Sn), lead (82Pb) |
| 15 | Nitrogen family | Nitrogen (7N), phosphorus (15P), arsenic (33AS), antimony (51Sb), bismuth (83Bi) |
Question 3.
i. Write the general outer electronic configuration of the elements of group 13, group 14 and group 15.
ii. By how many electrons do their outer electronic configurations differ from their nearest inert gas?
Answer:
i.
| Group | General outer electronic configuration |
| 13 | ns2 np1 |
| 14 | ns2 np2 |
| 15 | ns2 np3 |
ii. The outer electronic configurations of the elements group 13, group 14 and group 15 differ from their nearest inert gas by 5, 4 and 3 electrons, respectively.
![]()
Question 4.
In which form do the elements of groups 13,14 and 15 occur in nature?
Answer:
- The elements of groups 13, 14 and 15 do not occur in free monoatomic state and are found as compounds with other elements.
- They also occur in the form of polyatomic molecules (such as N2, P4, C60) or polyatomic covalent arrays (such as graphite, diamond).
Question 5.
Write condensed electronic configurations of the following elements.
13Al, 49In, 14Si, 50Sn, 15P, 33As
Answer:
Condensed electronic configurations of
i. 13Al: [Ne]3s2 3p1
ii. 49In: [Kr]4d105s25p1
iii. 14Si: [Ne]3s23p2
iv. 50Sn: [Kr]4d105s25p2
v. 15P: [Ne]3s23p3
vi. 33As: [Ar]3d104s24p3
Note: Condensed electronic configurations of elements of groups 13, 14 and 15 are given in the table below.

Question 6.
Name the following.
i. A metalloid present in group 13.
ii. A group 13 element which is the third most abundant element in the earth’s crust.
Answer:
i. Boron
ii. Aluminium
Question 7.
Why boron is classified as a metalloid?
Answer:
Boron is glossy and hard solid like metals but a poor conductor of electricity like nonmetals. Since it exhibits properties of both metals and nonmetals, boron is classified as a metalloid.
![]()
Question 8.
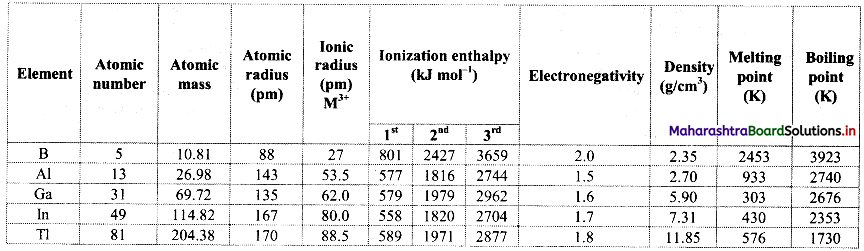
Describe the variation in the electronegativity of group 13 elements.
Answer:
- In group 13, on moving down the group, the electronegativity decreases from B to Al.
- However, there is a marginal increase in the electronegativity from Al to Tl.
- This trend is a result of the irregularities observed in atomic size of elements.
Question 9.
Atomic numbers of the group 13 elements are in the order B < Al < Ga < In < Tl. Arrange these elements in increasing order of ionic radii of M3+.
Answer:
- The given elements are in an increasing order of their atomic number.
- The general outer electronic configuration of group 13 elements is ns2np1.
- M3+ ion is formed by the removal of three electrons from the outermost shell ‘n’.
- In the M3+ ions, the ‘n-1’ shell becomes the outermost shell. Size of the ‘n-1’ shell increases down the group.
Therefore, the ionic radii of M3+ ion increases down the group in the following order:
B3+ < Al3+ < Ga3+ < In3+ < Tl3+
Question 10.
Why the atomic radius of Gallium is less than that of aluminium?
Answer:
- Atomic radius of the elements increases down the group due to addition of new shells.
- Electronic configuration of Al is [Ne]3s23p1 while that of Ga is [Ar]3d104s24p1.
- As Al does not have d-electrons, it offers an exception to this trend.
- As we go from Al down to Ga the nuclear charge increases by 18 units. Out of the 18 electrons added, 10 electrons are in the inner 3d subshell of Ga. These d-electrons offer poor shielding effect.
- Therefore, the effect of attraction due to increased nuclear charge is experienced prominently by the outer electrons of Ga and thus, its atomic radius becomes smaller than that of Al.
Hence, the atomic radius of gallium is less than that of aluminium.
Question 11.
The values of the first ionization enthalpy of Al, Si and P are 577, 786 and 1012 kJ mol-1 respectively. Explain the observed trend.
Answer:
- The trend shows increasing first ionization enthalpy from Al to Si to P.
- Al, Si and P belong to the third period in the periodic table and hence, they have same valence shell.
- As we move across a period from left to right, the nuclear charge increases. Due to this, electrons in the valence shell are held more tightly by the nucleus as we go from Al to Si to P.
- Therefore, more energy is required to remove an electron from its outermost shell.
Hence, the value of first ionization enthalpy increases from Al to Si to P.
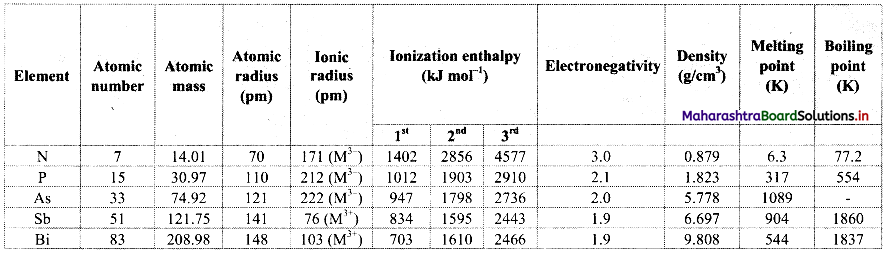
Note: Atomic and physical properties of group 13 elements.
![]()
Question 12.
Name metal(s), nonmetal(s) and metalloid(s) of group 14.
Answer:
i. Metal: Tin, lead
ii. Nonmetal: Carbon
iii. Metalloid: Silicon, germanium
Question 13.
Explain the variation in the following properties of the group 14 elements,
i. Atomic radii
ii. Ionization enthalpy
iii. Electronegativity
Answer:
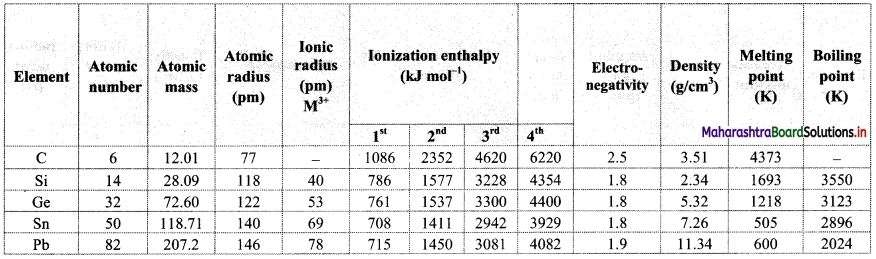
i. Atomic radii (Covalent radii):
- In the periodic table as we move down the group 14 from C to Pb, the atomic radii increases due to the addition of new shell at each succeeding element.
- However, the increase is comparatively less after silicon due to poor shielding by inner d- and f-electrons in the atoms.
ii. Ionization enthalpy:
- Due to increased effective nuclear charge, group 14 elements have higher value of ionization enthalpy than corresponding group 13 elements.
- In the periodic table, as we move down the group 14 from C to Sn, the ionization enthalpy decreases.
- From Si to Sn, the ionization enthalpy decreases slightly.
- However, from Sn to Pb, the ionization enthalpy increases slightly. It is due to the poor shielding effect of intervening d and f orbitals and increase in the size of the atoms.
iii. Electronegativity:
- Due to small atomic size, group 14 elements are slightly more electronegative than the corresponding group 13 elements.
- As we move down the group 14 from C to Si in the periodic table, the electronegativity decreases.
- The electronegativity values for elements from Si to Pb are almost the same.
- Among group 14 elements, carbon is the most electronegative with electronegativity of 2.5.
Question 14.
Explain why there is a phenomenal decrease in ionization enthalpy from carbon to silicon.
Answer:
- Carbon is the first element of group 14 and thus, it has the smallest atomic size.
- The ionization enthalpy of carbon (1086 kJ mol-1) is very high due to its small atomic size (77 pm) and high electronegativity (2.5).
- However, the ionization enthalpy of silicon (786 kJ mol-1) decreases phenomenally due to the increase in its atomic size (118 pm) and low electronegativity (1.8).
Note: Atomic and physical properties of group 14 elements.
Question 15.
Which type of elements are present in group 15? Mention their physical state.
Answer:
- Group 15 includes all the three traditional types of elements i.e., metals, nonmetals and metalloids.
- Nitrogen is a gas whereas the remaining group 15 elements are solids.
- The gaseous nitrogen and brittle phosphorus are nonmetals.
- Arsenic and antimony are metalloids while bismuth is moderately reactive metal.
![]()
Question 16.
Explain the trends in physical properties of group 15 elements.
i. Atomic and ionic radii
ii. Ionization enthalpy
iii. Electronegativity
Answer:
i. Atomic and ionic radii:
- Atomic size increases down the group with increasing atomic number.
- The effective nuclear charge in case of group 15 elements is larger than that of group 14 elements. Due to the increased effective nuclear charge, electrons are strongly attracted by the nucleus. Thus, the atomic and ionic radii of group 15 elements are smaller than the atomic and ionic radii of the corresponding group 14 elements.
- On moving down the group, number of shells increases which leads to increased shielding effect and as a result atomic radii and ionic radii increases.
ii. Ionization enthalpy:
- Due to extra stability of half-filled p-orbitals and relatively smaller size of group 15 elements, ionization enthalpy of group 15 elements is much greater than that of the group 14 elements in the corresponding periods.
- On moving down the group, increase in atomic size and screening effect overcome the effective nuclear charge and thus, ionization enthalpy decreases.
iii. Electronegativity:
- Due to smaller size and greater effective nuclear charge of atoms, group 15 elements have higher electronegativity values than group 14 elements.
- On moving down the group, electronegativity values decreases due to increase in the size of the atoms and shielding effect.
- Nitrogen is the most electronegative element among group 15 elements. However, there is not much of a difference between the electronegativity values of other elements of group 15.
Note: Atomic and physical properties of group 15 elements.
Question 17.
Write a note on the oxidation state of p-block elements with respect to groups 13, 14 and 15 elements.
Answer:
- Oxidation state is the primary chemical property of all elements.
- The highest oxidation state exhibited by the p-block elements is equal to the total number of valence electrons i.e., the sum of s- and p-electrons present in the valence shell. This is sometimes called the group oxidation state.
- In boron, carbon and nitrogen families, the group oxidation state is the most stable oxidation state for the lighter elements.
- Besides, the elements of groups 13, 14 and 15 exhibit other oxidation states which are lower than the group oxidation state by two units.
- The lower oxidation states become increasingly stable as we move down to heavier elements in the groups.
Note: Group oxidation states and common oxidation states with examples for groups 13, 14 and 15.
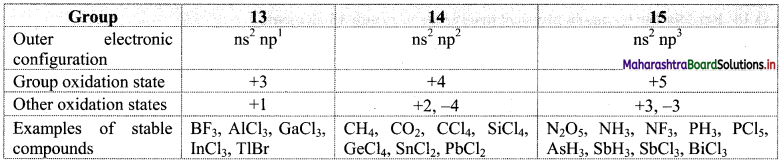
Question 18.
What are general oxidation states of group 13 elements? Explain.
Answer:
- The general oxidation states of group 13 are +1 and +3.
- The group 13 elements have the outermost electronic configuration ns2 np1.
- If only np1 electron takes part in bonding, the oxidation state is +1 and if all the three electrons i.e., ns2 np1 take part in bonding, the oxidation state is +3. Hence, the expected oxidation states are +1 and +3.
Question 19.
Give reason: The increased stability of the oxidation state is lowered by 2 units than the group oxidation state in heavier p-block elements.
Answer:
- The increased stability of the oxidation state lowered by 2 units than the group oxidation state in heavier p-block elements is due to inert pair effect.
- In these elements, the two s-electrons are involved less readily in chemical reactions.
- This is because, in heavier p-block elements, the s-electrons of valence shell experience poor shielding than valence p-electrons due to ten inner d-electrons.
Hence, the increased stability of the oxidation state is lowered by 2 units than the group oxidation state in heavier p-block elements.
![]()
Question 20.
Why Tl1+ ion is more stable than Tl3+?
Answer:
- Tl is a heavy element which belongs to group 13 of the p-block.
- The common oxidation state for this group is +3.
- In p-block, the lower oxidation state is more stable for heavier elements due to inert pair effect.
Hence, Tl1+ ion is more stable than Tl3+ ion.
Question 21.
How can you explain the higher stability of BCl3 as compared to TlCl3?
Answer:
- Boron is a light element in group 13 and has outermost electronic configuration 2s2 2p1 whereas thallium is a heavy element in group 13 and has outermost electronic configuration 6s2 6p1.
- Because of its small ionic radius, boron forms stable compounds in +3 oxidation state.
- Thallium has a large atomic size and due to the inert pair effect forms more stable compounds with lower oxidation state +1 than compounds with +3 oxidation state.
Therefore, BCl3 has higher stability than TlCl3.
Question 22.
State the oxidation state for the following:
i. The group oxidation state of group 14 elements.
ii. The stable oxidation state for lead.
iii. Oxidation state of carbon in CH4.
Answer:
i. +4
ii. +2
iii. -4
Question 23.
GeCl4 is more stable than GeCl2 while PbCl2 is more stable than PbCl4. Explain.
Answer:
- Elements Ge and Pb belong to 4th and 6th period in the group 14.
- The group oxidation state of group 14 elements is +4.
- However, the stability of other oxidation state which is lower by 2 units i.e., +2, increases down the group due to inert pair effect.
- Therefore, the stability of the oxidation state +4 is more in Ge than in Pb while the stability of the oxidation state +2 is more in Pb than in Ge.
Hence, GeCl4 is more stable than GeCl2 while PbCl2 is more stable than PbCl4.
Question 24.
Name the elements of group 14 which are generally occur in +2 oxidation state.
Answer:
The elements of group 14 that are generally occur in +2 oxidation state are tin (Sn) and lead (Pb).
Question 25.
Discuss the nature of bonding in compounds of group 13, 14 and 15 elements.
Answer:
- The lighter elements in groups 13, 14 and 15 have small atomic radii and high ionization enthalpy values. They form covalent bonds with other atoms by overlapping of valence shell orbitals.
- As we move down the group, the value of ionization enthalpy decreases. The atomic radius increases since the valence shell orbitals are more diffused.
- The heavier elements in these groups tend to form ionic bonds. The first member of these groups belongs to second period and do not have d orbitals and hence, B, C and N cannot expand their octet.
- The subsequent elements in the group possess vacant d orbital in their valence shell, which can expand their octet forming a variety of compounds.
![]()
Question 26.
Explain the reactivity of groups 13, 14 and 15 elements towards air.
Answer:
i. Group 13 elements:
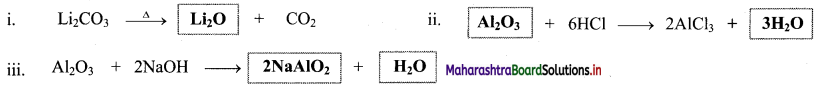
a. On heating with air or oxygen, group 13 elements form oxide of the type E2O3.
\(4 \mathrm{E}_{(\mathrm{s})}+3 \mathrm{O}_{2(\mathrm{~g})} \stackrel{\Delta}{\longrightarrow} 2 \mathrm{E}_{2} \mathrm{O}_{3(\mathrm{~s})}\) (where, E = B, Al, Ga, In, Tl)
b. At high temperature, group 13 elements also react with nitrogen present in the air to form corresponding nitrides.
\(2 \mathrm{E}_{(\mathrm{s})}+\mathrm{N}_{2(\mathrm{~g})} \stackrel{\Delta}{\longrightarrow} 2 \mathrm{EN}_{(\mathrm{s})}\) (where, E = B, Al, Ga, In, Tl)
ii. Group 14 elements: The elements of group 14 on heating in air or oxygen form oxide of the type EO and EO2 in accordance with the stable oxidation state and availability of oxygen.
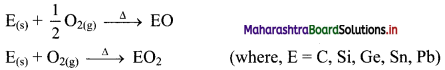
iii. Group 15 elements: The elements of group 15 on heating in air or oxygen forms two types of oxide i.e., E2O3 and E2O5.
![]()
Due to increase in metallic character down the groups 13, 14 and 15, the nature of their oxides gradually varies from acidic through amphoteric to basic.
[Note: The temperature required for the reaction of nitrogen with oxygen is very high. This is produced by striking an electric arc.]
Question 27.
Classify the following oxides into acidic, basic or amphoteric.
B2O3, Ga2O3, Tl2O3, In2O3, Al2O3
Answer:
| Acidic oxide | B2O3 |
| Basic oxides | In2O3, Tl2O3 |
| Amphoteric oxides | Al2O3, Ga2O3 |
Question 28.
Match the following.
| Column A | Column B | ||
| i. | N2O5 | a. | Amphoteric |
| ii. | Bi2O3 | b. | Acidic |
| iii. | Sb2O3 | c. | Basic |
Answer:
i – b,
ii – c,
iii – a
Note: Nature of stable oxides of groups 13, 14 and 15 elements
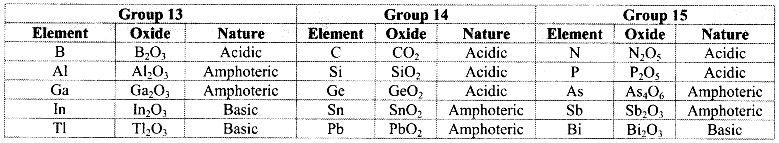
Question 29.
State TRUE or FALSE. Correct the false statement.
i. Sb is more stable in +3 oxidation state.
ii. Oxides of the type E2O5 are formed by group 15 elements.
iii. As4O6 is an acidic oxide.
Answer:
i. True
ii. True
iii. False
As4O6 is an amphoteric oxide.
![]()
Question 30.
What happens when the elements of groups 13, 14 and 15 react with water?
Answer:
i. Most of the elements of groups 13, 14 and 15 are unaffected by water.
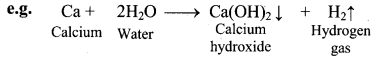
ii. Aluminium reacts with water on heating and forms hydroxide while tin reacts with steam to form oxide.
![]()
iii. Lead is unaffected by water due to the formation of a protective film of oxide.
Question 31.
Why is phosphorus stored under water?
Answer:
Phosphorus is highly reactive and hence, it is stored under water to prevent its reaction with air as it catches fire on being exposed to air.
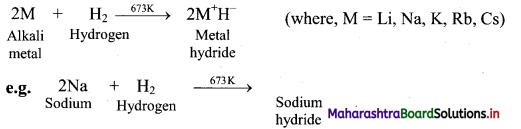
Question 32.
Explain the reactivity of group 13 elements towards halogens.
Answer:
i. All the elements of group 13 react directly with halogens to form trihalides (EX3).
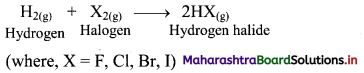
2E(S) + 3X2(g) → 2EX3(s) (where, E = B, Al, Ga, In and X = F, Cl, Br, I)
ii. Thallium is an exception as it forms monohalides (TlX).
Question 33.
Describe the reactivity of group 14 elements with halogens.
Answer:
- All the elements of group 14 (except carbon) react directly with halogens to form tetrahalides (EX4).
- The heavy elements Ge and Pb form dihalides as well.
- Stability of dihalides increases down the group due to inert pair effect.
- The ionic character of halides also increases steadily down the group.
Question 34.
Discuss the reactivity of group 15 elements with halogens.
Answer:
- Elements of the group 15 reacts with halogens to form two series of halides i.e., trihalides (EX3) and pentahalides (EX5).
- The pentahalides possess more covalent character due to availability of vacant d orbitals of the valence shell for bonding.
- Nitrogen being second period element, does not have d orbitals in its valence shell, and therefore, does not form pentahalides.
- Trihalides of the group 15 elements are predominantly covalent except BiF3. The only stable trihalide of nitrogen is NF3.
![]()
Question 35.
Nitrogen does not form pentahalides. Give reason.
Answer:
- The electronic configuration of 7N is 1s2 2s2 2p3. It has 3 unpaired electrons which can form 3 covalent bonds, thus forming NX3 molecule.
- Valence shell of nitrogen (n = 2) contains only s and p orbitals.
- Thus, due to the absence of d orbitals in the valence shell, nitrogen cannot expand its octet, therefore, it cannot form compounds like NCl5 and NF5.
Hence, nitrogen does not form pentahalides.
Question 36.
Nitrogen does not form NCl5 or NF5 but phosphorus can. Explain.
Answer:
- The electronic configuration of 7N is 1s2 2s2 2p3 while that of 15P is 1s2 2s2 2p6 3s2 3p3.
- As phosphorus contains d orbitals, it can expand its octet to form MX3 as well MX5 compounds.
- However, due to absence of d orbitals, nitrogen cannot form MX3 or MX5.
Hence, Nitrogen does not form NCl5 or NF5 but phosphoms can form compounds like PCl5 or PF5.
Question 37.
Define catenation.
Answer:
The property of self-linking of atoms of an element by covalent bonds to form chains and rings is called catenation.
Question 38.
Explain catenation of group 14 elements.
Answer:
i. The property of self-linking of atoms of an element by covalent bonds to form chains and rings is called catenation.
ii. The strength of the element-element bond determines the tendency of an element to form a chain.
iii. Among the elements of group 14, the bond strength is maximum for C-C bond (348 kJ mol-1). Hence, carbon has maximum tendency for catenation.
| Bond | Bond strength (Bond enthalpy kJ mol-1) |
| C-C | 348 |
| Si-Si | 297 |
| Ge-Ge | 260 |
| Sn-Sn | 240 |
iv. From the values of bond enthalpy, it can be concluded that the tendency to form chains is maximum for carbon and much lesser for silicon. Germanium has still lesser tendency and tin has hardly any tendency for catenation. Lead does not show catenation.
Therefore, the order of catenation of group 14 elements is C >> Si > Ge = Sn.
Question 39.
State TRUE or FALSE. Correct the false statement.
i. Among the group 14 elements, Ge does not show the property of catenation.
Answer:
i. False
Among the group 14 elements, Pb (lead) does not shows the property of catenation.
![]()
Question 40.
Define allotropy.
Answer:
When a solid element exists in different crystalline forms with different physical properties such as colour, density, melting point, etc. the phenomenon is called allotropy.
Question 41.
i. What are allotropes?
ii. Name various allotropes of carbon.
Answer:
i. When a solid element exists in different crystalline forms with different physical properties such as colour, density, melting point, etc. the phenomenon is called allotropy and the individual crystalline forms are called allotropes.
ii. Diamond, graphite, fiillerenes, graphene and carbon nanotubes are various allotropes of carbon.
Question 42.
Explain the structure of diamond.
Answer:
Structure of diamond:
- In diamond, each carbon atom undergoes sp3 hybridization and is linked to four other carbon atoms in tetrahedral manner.
- The C – C bond length is 154 pm.
- The tetrahedra are linked together forming a three-dimensional network structure involving strong C-C single bonds which makes diamond the hardest natural substance.
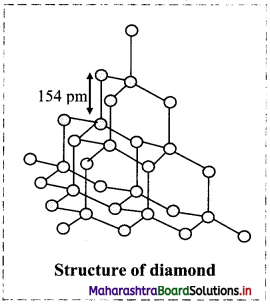
Question 43.
Write physical properties of diamond. Also, state its uses.
Answer:
i. Physical properties
- Diamond is the hardest natural substance.
- It has abnormally high melting point (3930 °C).
- It is a bad conductor of electricity.
ii. Uses: Diamond is used
- for cutting glass and in drilling tools.
- for making dies for drawing thin wire from metal.
- for making jewellery.
![]()
Question 44.
Describe the structure of graphite.
Answer:
- Graphite is composed of layers of two-dimensional sheets of carbon atoms.
- Each sheet is made up of hexagonal net of sp2 carbons bonded to three neighbours forming three bonds.
- The fourth electron in the unhybrid p-orbital of each carbon is shared by all carbon atoms resulting in a π bond. These it electrons are delocalized over the whole layer.
- The C – C bond length in graphite is 141.5 pm.
- The individual layers are held by weak van der Waals forces and separated by 335 pm.
- Graphite is soft and slippery and is thermodynamically most stable allotrope of carbon.
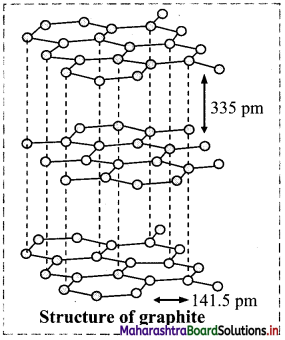
Question 45.
Diamond is very hard whereas graphite is soft. Explain.
Answer:
- Diamond has three-dimensional network of sp3 hybridized carbon atoms joined by extended covalent bonds which are difficult to break. Therefore, diamond is hard.
- Graphite has two-dimensional sheet like structure, like layers of hexagonal rings formed from sp2 hybridized carbon atoms. These layers are held by weak van der Waals forces, which can be broken easily. Therefore, graphite is soft and slippery.
Hence, diamond is very hard whereas graphite is soft.
Question 46.
i. What are fullerenes?
ii. How are they prepared?
Answer:
i. Fullerenes are allotropes of carbon in which carbon molecules are linked by a definite numbers of carbon atoms, for example as in C60.
ii. Fullerenes are produced when an electric arc is struck between the graphite electrodes in an inert atmosphere of argon or helium. The soot formed contains significant amount of C60 fullerene and smaller amounts of other fullerenes C32, C50, C70 and C84.
Question 47.
Discuss the structure and properties of fullerene (C6o).
Answer:
- C60 has a shape like soccer ball and called Buckminsterfullerene or bucky ball.
- It contains 20 hexagonal and 12 pentagonal fused rings of carbon.
- The C60 fullerene structure exhibit separations between the neighbouring carbons as 143.5 pm and 138.3 pm.
- Fullerenes are covalent and soluble in organic solvents.
- Fullerene C60 reacts with group 1 metals forming solids such as K3C60.
- The compound K3C60 behaves as a superconductor below 18 K, which means that its carries electric current with zero resistance.
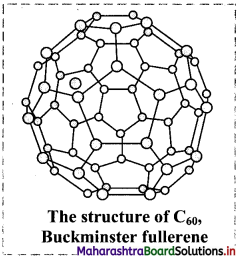
Question 48.
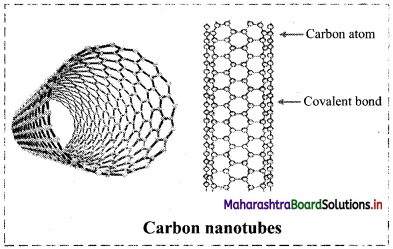
Explain the structure of carbon nanotubes.
Answer:
- Carbon nanotubes are cylindrical in shape consisting of rolled-up graphite sheet.
- Nanotubes can be single-walled (SWNTs) with a diameter of less than 1 nm or multi-walled (MWNTs) with diameter reaching more than 100 nm.
- Their lengths range from several micrometres to millimetres.
![]()
Question 49.
Describe the properties of carbon nanotubes.
Answer:
- Carbon nanotubes are robust. They can be bent, and when released, they will spring back to the original shape.
- Carbon nanotubes have high electrical or heat conductivities and highest strength-to-weight ratio for any known material to date.
- The researchers of NASA are combining carbon nanotubes with other materials into composites that can be used to build lightweight spacecraft.
Question 50.
What is graphene?
Answer:
- Isolated layer of graphite is called graphene.
- Graphene sheet is a two dimensional solid.
- It has unique electronic properties.
Question 51.
Explain the structure of various allotropes of phosphorus.
Answer:
Phosphorus is found in different allotropic forms. White and red phosphorus are important allotropes of phosphorus.
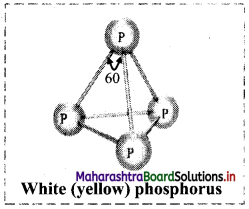
i. White (yellow) phosphorus:
- White (yellow) phosphorus consists of discrete tetrahedral P4 molecules.
- The P – P – P bond angle is 60°.
- White phosphorus is less stable and hence more reactive, because of angular strain in the P4 molecule.
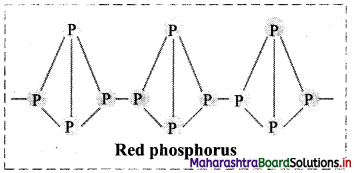
ii. Red phosphorus:
- Red phosphorus consists of chains of P4 linked together by covalent bonds.
- Thus, it is polymeric in nature.
Question 52.
Enlist properties of
i. white phosphorus.
ii. red phosphorus.
Answer:
i. Properties of white phosphorus:
- It is translucent white waxy solid.
- It glows in the dark (chemiluminescence).
- It is insoluble in water but dissolves in boiling NaOH solution.
- It is poisonous.
ii. Properties of red phosphorus:
- It is stable and less reactive.
- It is odourless and possess iron grey lustre.
- It does not glow in the dark.
- It is insoluble in water.
- It is nonpoisonous.
![]()
Question 53.
How is red phosphorus prepared?
Answer:
Red phosphorus is prepared by heating white phosphorus at 573 K in an inert atmosphere.
Question 54.
State whether the following statement is TRUE or FALSE. Correct if false.
i. Covalent molecules have irregular shape described with the help of bond lengths and bond angles.
ii. It is difficult to understand the reactivity of covalent inorganic compounds from their structures.
iii. Inorganic molecules are often represented by molecular formulae indicating their elemental composition.
Answer:
i. False
Covalent molecules have definite shape described with the help of bond lengths and bond angles.
ii. False
The reactivity of covalent inorganic compounds is better understood from their structures.
iii. True
![]()
Question 55.
Describe structure of the following molecules.
i. Boron trichloride
ii. Aluminium chloride
iii. Orthoboric acid
Answer:
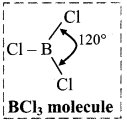
i. Structure of boron trichloride (BCl3) molecule:
- Boron trichloride (BCl3) is a covalent compound.
- In BCl3 molecule, boron atom is sp2 hybridized having one vacant unhybridized p orbital.
- B in BCl3 has incomplete octet.
- BCl3 is a nonpolar trigonal planar molecule.
- Each Cl – B – Cl bond angle is 120°.
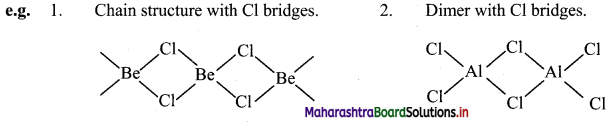
ii. Structure of aluminium chloride (AlCl3) molecule:
- Aluminium atom in aluminium chloride is sp2 hybridized, with one vacant unhybrid p-orbital.
- Aluminium chloride exists as the dimer (Al2Cl6) formed by overlap of vacant 3d orbital of Al with a lone pair of electrons of Cl.
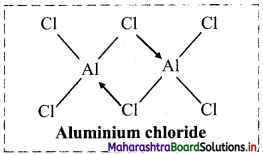
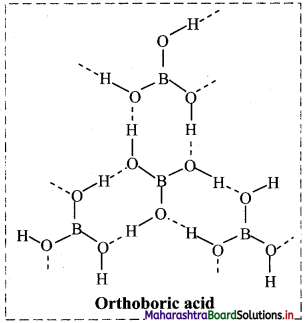
iii. Structure of orthoboric or boric acid (H3BO3) molecule:
- Orthoboric acid has central boron atom bound to three -OH groups.
- The solid orthoboric acid has layered crystal structure in which trigonal planar B(OH)3 units are joined together by hydrogen bonds.
Question 56.
Which are the different crystalline forms of silica?
Answer:
Quartz, cristobalite and tridymite are the different crystalline forms of silica.
[Note: These crystalline forms are inter-convertible at a suitable temperature.]
Question 57.
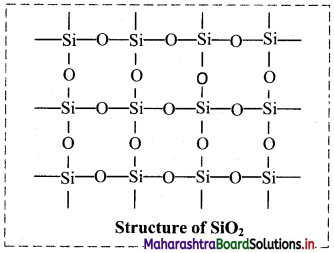
Explain the structure of silicon dioxide.
Answer:
- Silicon dioxide (SiO2), is also known as silica.
- It is a covalent three-dimensional network solid.
- In SiO2, each silicon atom is covalently bound in tetrahedral manner to four oxygen atoms.
- The crystal contains eight membered rings having alternate silicon and oxygen atoms.
Question 58.
Discuss the nature and structure of the following compounds.
i. Nitric acid
ii. Phosphoric acid
Answer:
i. Nitric acid:
- Nitric acid (HNO3) is a strong, oxidizing mineral acid.
- The central nitrogen atom is sp2 hybridized.
- HNO3 exhibits resonance phenomenon.
- Figure (a) represents resonating structures of HNO3 while figure (b) represents resonance hybrid of HNO3.

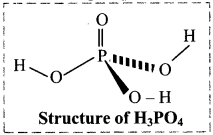
ii. Phosphoric acid (Orthophosphoric acid):
- Phosphorus forms number of oxyacids. Orthophosphoric acid (H3PO4) is a strong nontoxic mineral acid.
- It contains three ionizable acidic hydrogens.
- The central phosphorus atom is tetrahedral.
Question 59.
Give the molecular formula of crystalline borax.
Answer:
The crystalline borax has formula Na2B4O7.10H2O or Na2[B4O5(OH)4].8H2O.
![]()
Question 60.
How is borax obtained from its mineral colemanite?
Answer:
Borax is obtained from its mineral colemanite by boiling it with a solution of sodium carbonate.
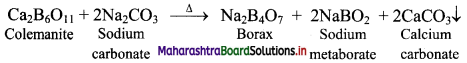
Question 61.
Why is the aqueous solution of borax alkaline?
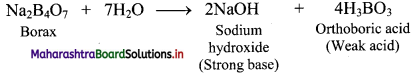
Answer:
On hydrolysis, borax forms a strong base (NaOH) and a weak acid (H3BO3). The presence of the strong base makes borax solution alkaline.
Question 62.
What happens when borax is heated strongly?
Answer:
Borax is a white crystalline solid. On heating, borax loses water molecules and swells up. On further heating, it melts and forms a transparent liquid, which solidifies into a glass like material known as borax bead.
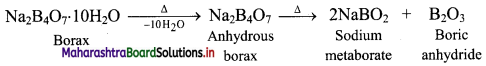
Question 63.
Explain borax bead test.
Answer:
i. Borax bead test is used to detect coloured transition metal ions.
ii. On heating, borax loses water molecules and swells up. On further heating, it melts and forms a transparent liquid, which solidifies into a glass like material known as borax bead.
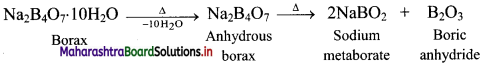
iii. The borax bead consists of sodium metaborate and boric anhydride, which reacts with metals salts to form coloured bead.
e.g. When borax is heated in a Bunsen burner flame with CoO on a loop of platinum wire, a blue coloured Co(BO2)2 bead is formed.

Question 64.
Write the uses of borax.
Answer:
Borax is used
- to manufacture optical and hard borosilicate glasses.
- as a flux for soldering and welding.
- as a mild antiseptic in the preparation of medical soaps.
- in qualitative analysis for borax bead test.
- as a brightener in washing powder.
Question 65.
How are silicones prepared? Write their properties.
Answer:
i. Preparation of silicones:
a. Alkyl or aryl substituted silicon chlorides having general formula RnSiCl(4-n) (R = alkyl or aryl group) are used as the starting materials for manufacture of silicones.
b. When methyl chloride reacts with silicon in the presence of copper catalyst at a temperature 573 K, various types of methyl substituted chlorosilane of formula MeSiCl3, Me2SiCl2, Me3SiCl with small amounts of Me4Si are formed.
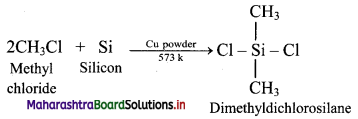
c. Hydrolysis of dimethyldichlorosilane, (CH3)2SiCl2 followed by condensation polymerisation yields straight chain silicone polymers.
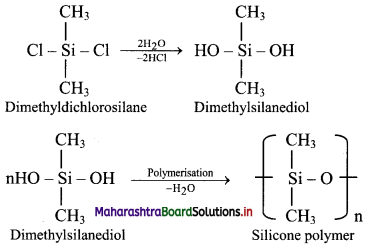
d. The chain length of polymer can be controlled by adding (CH3)3SiCl at the end.
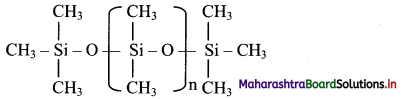
ii. Properties:
- Silicones are water repellent.
- They have high thermal stability.
- They are good electrical insulators.
- They are resistant to oxidation and chemicals.
![]()
Question 66.
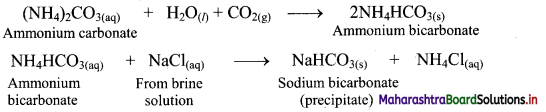
Explain the preparation of ammonia from nitrogeneous organic matter.
Answer:
Ammonia is formed by the decomposition of nitrogeneous organic matter such as urea. It is therefore, present naturally in small quantities in air and soil.
![]()
Question 67.
Describe laboratory method for preparation of ammonia.
Answer:
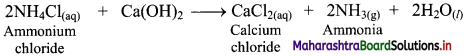
Ammonia is prepared on laboratory scale by decomposition of the ammonium salts with calcium hydroxide or caustic soda.
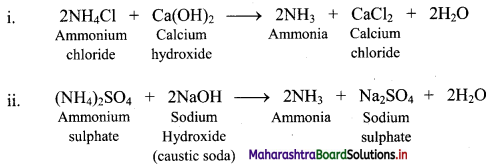
Question 68.
How is ammonia manufactured by Haber process?
Answer:
- On the large scale, ammonia is prepared by direct combination of dinitrogen and dihydrogen by Haber process.
- In this process, dinitrogen reacts with dihydrogen under high pressure of 200 × 105 Pa (200 atm) and temperature around 700 K to produce ammonia.
N2(g) + 2H2(g) ⇌ 2NH3(g); ΔfH° = -46.1 kJ mol-1 - Iron oxide with trace amounts of K2O and Al2O3 is used as catalyst in Haber process.
- High pressure favours the formation of ammonia as equilibrium is attained rapidly under these conditions.
Question 69.
State the physical properties of ammonia.
Answer:
- Ammonia is a colourless gas with pungent odour.
- It has freezing point of 198.4 K and boiling point of 239.7 K.
- It is highly soluble in water.
Question 70.
What is liquor ammonia?
Answer:
The concentrated aqueous solution of ammonia (NH3) is called liquor ammonia.
Question 71.
Give reason: Ammonia has higher melting and boiling points.
Answer:
- In solid and liquid state, NH3 molecules get associated together through hydrogen bonding.
- As a result, extra amount of energy is required to break such intermolecular hydrogen bonds. Hence, ammonia has higher melting and boiling points.
![]()
Question 72.
Why is ammonia basic in aqueous solution?
Answer:
i. As ammonia is highly soluble in water, it readily forms OH– ions in its aqueous solution.
\(\mathrm{NH}_{3(\mathrm{~g})}+\mathrm{H}_{2} \mathrm{O}_{(l)} \rightleftharpoons \mathrm{NH}_{4(\mathrm{aq})}^{+}+\mathrm{OH}_{(a q)}^{-}\)
ii. Thus, due to the formation of OH– ions, aqueous solution of ammonia is basic in nature.
Question 73.
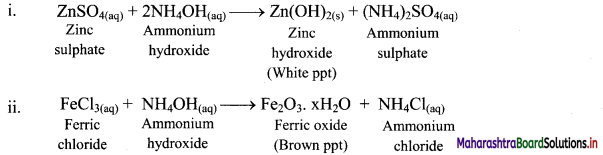
How does the aqueous solution of ammonia react with the following salt solutions?
i. ZnSO4
ii. FeCl3
Answer:
Aqueous solution of ammonia precipitates out as hydroxides (or hydrated oxides) of metals solutions.
Question 74.
Write applications of ammonia.
Answer:
Ammonia is used in
- manufacture of fertilizers such as urea, diammonium phosphate, ammonium nitrate, ammonium sulphate etc.
- manufacture of some inorganic compounds like nitric acid.
- refrigerant (liq. ammonia).
- laboratory reagent in qualitative and quantitative analysis (aq. solution of ammonia).
Question 75.
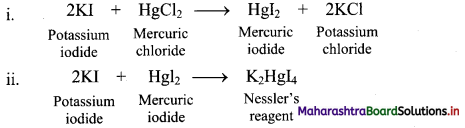
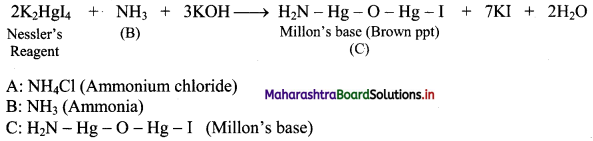
Give reactions involved in the formation of Nessler’s reagent.
Answer:
Question 76.
How does ammonia react with Nessler’s reagent?
Answer:
Ammonia react with Nessler’s reagent (an alkaline solution of K2HgI4) to form a brown precipitate (Millon’s base).
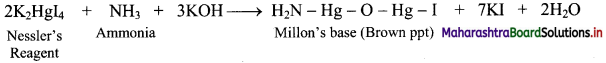
Question 77.
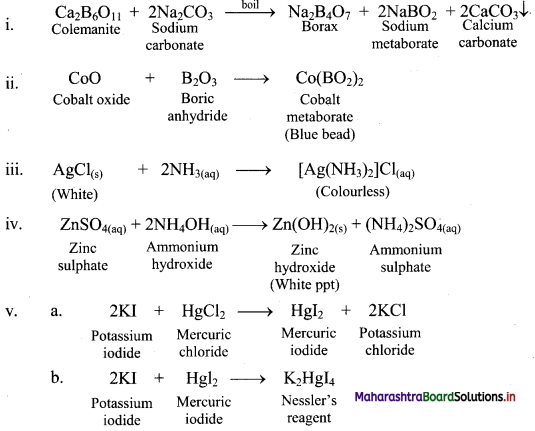
Complete and write the balanced chemical equations for:
i. Ca2B6O11 + Na2CO3 →
ii. CoO + B2O3 →
iii. AgCl + NH3 →
iv. ZnSO4 + 2NH4OH →
v. a. 2KI + HgCl2 →
b. 2KI + HgI2 →
Answer:
![]()
Question 78.
Naina was preparing a compound in the laboratory. She added compound ‘A’ to (CaOH)2 solution. As a result of this, a compound ‘B’ was obtained which had a pungent smell. On adding Nessler’s reagent to the compound ‘B’, a brown precipitate of compound ‘C’ was obtained.
Write the chemical reactions involved and identify ‘A’, ‘B’ and ‘C’.
Answer:
i. When ammonium chloride is mixed with (CaOH)2 solution, ammonia is formed which has a pungent odour.
![]()
ii. Ammonia react with Nessler’ s reagent (an alkaline solution of K2Hgl4) to form a brown precipitate (Millon’ s base).
Multiple Choice Questions
1. The electronic configuration of boron family is ……………
(A) ns2 np2
(B) ns2 np5
(C) ns2 np6
(D) ns2 np1
Answer:
(D) ns2 np1
2. ………… has noble gas core plus 14 f-electrons and 10 d-electrons.
(A) Gallium
(B) Indium
(C) Thallium
(D) Boron
Answer:
(C) Thallium
3. The group 15 element having inner electronic configuration as of argon is …………..
(A) Phosphorus (Z = 15)
(B) Antimony (Z = 51)
(C) Arsenic (Z = 33)
(D) Nitrogen (Z = 7)
Answer:
(C) Arsenic (Z = 33)
![]()
4. Which of the following is NOT a metalloid?
(A) B
(B) Sn
(C) Ge
(D) Sb
Answer:
(B) Sn
5. Among the group 13 elements, melting point is highest for …………..
(A) B
(B) Al
(C) Ga
(D) In
Answer:
(A) B
6. On moving down the group 14, the ionization enthalpy
(A) increases slightly from Si to Sn and decreases slightly from Sn to Pb
(B) increases throughout uniformly from Si to Pb
(C) decreases throughout uniformly from Si to Pb
(D) decreases slightly from Si to Sn and increases slightly from Sn to Pb
Answer:
(D) decreases slightly from Si to Sn and increases slightly from Sn to Pb
7. ………… is the most electronegative element of group 14.
(A) Carbon
(B) Silicon
(C) Germanium
(D) Tin
Answer:
(A) Carbon
8. The stability of +3 oxidation state in aqueous solution is in order ……………
(A) Al > Ga > In > Tl
(B) Tl > In > Ga > Al
(C) Al > Tl > Ga > In
(D) Tl > Al > Ga > In
Answer:
(A) Al > Ga > In > Tl
9. Group oxidation state of group 15 elements is ……………
(A) +4
(B) +1
(C) +3
(D) +5
Answer:
(D) +5
![]()
10. …………. cannot expand its octet due to absence of d orbital in its valence shell.
(A) Ga
(B) C
(C) As
(D) Ge
Answer:
(B) C
11. Which one of the following statements about boron and aluminium is INCORRECT?
(A) Both exhibit oxidation state of +3.
(B) Both form oxides of the formula M2O3.
(C) Both form trihalides, MX3.
(D) Both form amphoteric oxides.
Answer:
(D) Both form amphoteric oxides.
12. Which of the following is basic oxide?
(A) Bi2O3
(B) CO2
(C) B2O3
(D) SiO2
Answer:
(A) Bi2O3
13. The reaction of Al with H2O produces ……………
(A) Al2O3
(B) AlH3
(C) Al(OH)3
(D) Al2H6
Answer:
(C) Al(OH)3
14. Which of the following is a stable halide of nitrogen?
(A) NF3
(B) NCl5
(C) NF5
(D) NBr5
Answer:
(A) NF3
![]()
15. Catenation is the ability of …………..
(A) atoms to form strong bonds with similar atoms
(B) elements to form giant molecules
(C) an element to form multiple bonds
(D) an element to form long chains of identical atoms
Answer:
(D) an element to form long chains of identical atoms
16. Among the group 13 elements, the property of allotropy is shown by ………………
(A) indium
(B) aluminium
(C) thallium
(D) boron
Answer:
(D) boron
17. Thermodynamically stable allotrope of carbon is …………..
(A) diamond
(B) graphite
(C) buckyball
(D) all of these
Answer:
(B) graphite
18. White phosphorus contains discrete …………… molecules.
(A) P5
(B) P4
(C) P6
(D) P52
Answer:
(B) P4
19. In white phosphorus, the P-P-P bond angle is ……………
(A) 60°
(B) 90°
(C) 109.5
(D) 120°
Answer:
(A) 60°
20. 3c-2e bonds are present in ………………
(A) NH3
(B) B2H6
(C) H3BO3
(D) SiCl4
Answer:
(B) B2H6
![]()
21. Which of the following is borax?
(A) Na2B4O7.4H2O
(B) Na2B4O7.10H2O
(C) H3BO3
(D) NaBO2
Answer:
(B) Na2B4O7.10H2O
22. In Borax bead test, the coloured ions give characteristic coloured beads due to formation of …………….
(A) metal borates
(B) metal metaborates
(C) metal phosphates
(D) metal tetraborates
Answer:
(B) metal metaborates
23. The catalyst used in Haber process contains …………..
(A) nickel
(B) palladium
(C) iron
(D) platinum
Answer:
(C) iron
24. Which of the following is used as refrigerant?
(A) Nessler’s reagent
(B) Liq. ammonia
(C) Borax
(D) Diborane
Answer:
(B) Liq. ammonia